Konu-14: Asit ve Bazlar
1 sayfadaki 1 sayfası
 Konu-14: Asit ve Bazlar
Konu-14: Asit ve Bazlar
ASİT – BAZ KAVRAMLARI
• ASİT – BAZ KAVRAMLARI
Asit: Sulu çözeltilere H+ iyonu verebilen maddelerdir.
Baz: Sulu çözeltilere OH– iyonu verebilen maddelerdir.
Diğer bir ifadeyle H+ iyonu verebilen maddelere asit, H+ iyonu alabilen maddelere baz denir.
Bu genel tanıma göre;
HF + H2O <==> H3O+ + F-
denkleminde HF, H+ iyonu verebildiğinden asit, H2O, H+ iyonu alabildiğinden bazdır.
Tepkime çift yönlü olduğundan H3O+ iyonu, H+ iyonu verebildiğinden asit, F– ise H+ alabildiğinden bazdır.
HF + H2O <==>H3O+ + F-
Asit-1...Baz-2......Asit-2...Baz-1
şeklinde yazılabilir. Bu ise herbir asit ve bazın birer eşlenik asit-baz çiftinden oluştuğunu gösterir.
Örnek olarak:
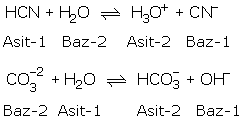
Aynı numarayla gösterilen asit baz çiftine konjuge asit-baz çifti denir.
SUYUN İYON DENKLEMİ
Su çok az dahi olsa elektrik akımını ilettiğine göre, su içerisinde iyonların bulunduğu aklımıza gelmelidir.
H2O(s) <==> H+(aq) + OH-(aq)
şeklinde iyonlaşır.
Olay bir denge olayı olduğundan denge sabitine suyun denge sabiti (Ksu) denir.
25 °C de deneysel olarak Ksu değeri 1.10–14 olarak hesaplanmıştır.
Ksu = [H+].[OH–]
eşitliği bütün sulu çözeltiler için geçerlidir.
Asit suya H+ iyonu vereceğine göre [H+] = [OH–] eşitliği bozularak [H+] > [OH–] olacaktır.
Baz suya OH– iyonu verecek ya da H+ iyonu alacaktır.
Baz çözeltisi için [H+] < [OH–] söz konusu olacaktır.
[H+] = [OH–] = 1.10–7 M ise ortam nötr
[H+] > [OH–] ise çözelti asidik
[H+] < [OH–] ise çözelti bazik
[H+] > 1.10–7 M ise çözelti asit
[H+] < 1.10–7 M ise çözelti baz
[OH–] > 1.10–7 M ise çözelti baz
Not: Bir çözelti asit çözeltisi ise işlemler H+ iyonlarıyla yapılmalıdır. Çözelti baz çözeltisi ise işlemler OH– iyonlarıyla yapılmalıdır.
pH ve pOH
pH = –log[H+]
pOH = –log[OH–]
pH + pOH = 14
eşitlikleri yardımıyla bir çözeltinin [H+] derişimi ya da [OH–] derişimi bilinirse pH’ı ya da pOH'sı, pH'ı ya da pOH'ı bilinen bir çözeltinin [H+] derişimi ya da [OH–] derişimi bulunur.
Saf su için;
[H+]= [OH–]= 1.10–7 olduğundan
pH = –log[1.10–7]
pH = 7
pOH = –log[1.10–7]
pOH = 7 bulunur.
Asit
1. [H+] > [OH–]
2. [H+] > 10–7 M
3. [OH–] < 10–7 M
4. pH < 7
5. pOH > 7
6. pH < pOH
Baz
1. [H+] < [OH–]
2. [H+] < 10–7 M
3. [OH–] > 10–7 M
4. pH > 7
5. pOH < 7
6. pH > pOH
Örnek - 1
Bir asit çözeltisinin [H+] derişimi 1.10–3 M ise bu çözeltinin pH ve pOH'ı nedir?
Çözüm
[H+] = 1.10–3 M ise
pH = –log[H+]
pH = –log[1.10–3]
pH = 3
pOH = 11 olarak bulunur.
ZAYIF ASİT ve BAZLAR (Ka ve Kb)
Kuvvetli asitler ve bazlar suda % 100 iyonlaştıklarından bunlarla ilgili soruları denge sabiti kullanmadan çözüyorduk. Ancak zayıf asit ve bazlarda %100 iyonlaşma olmadığından bir denge söz konusudur.
Zayıf HA asiti için;

Şeklinde denge denklemleri yazılabilir.

Zayıf asitler için uygulanan işlemlerden hareket ederek zayıf bazlar için gerekli eşitlikler elde edilebilir.
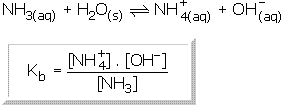
Örnek - 2
0,1 M lık HA asitinin pH =3 tür. Buna göre, asitin Ka sı kaçtır?
Çözüm
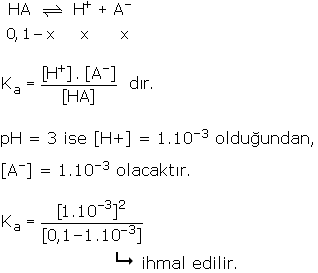
0,1 in yanında 1.10–3 çok küçük olduğundan ihmal edilir.
Ka = 1.10–5 olarak hesaplanır.
NÖTÜRLEŞME
Asit + Baz --> Tuz + H2O
reaksiyonuna nötrleşme reaksiyonu denir. Herhangi bir asitle herhangi bir bazın tepkimeye girerek tuz oluşturması işlemine nötrleşme olayı denir.
Genel nötürleşme denklemi
H+ + OH– --> H2O şeklindedir.
Asitten gelen H+ iyonlarıyla bazdan gelen OH– iyonlarının birleşmesi olayı nötürleşmedir. Asitten gelen H+ iyonlarının mol sayısı ile, bazdan gelen OH– iyonlarının mol sayısı birbirine eşit ise ortam nötr olur. Yani pH = 7 olur.
TAMPON ÇÖZELTİLER
Sinan Hoca diyor ki;
Herhangi bir çözeltinin pH değerini değişime karşı direndirmek amacı için hazırlanan çözeltilerdir. Yani tampon çözeltilerin pH'ları belirli değerlerde sabitlenmiştir değiştirilmesi normal çözeltilere göre zordur. Örneğin insan kanı doğal bir tampon çözeltidir çünkü kan pH'ı insan yaşamı için değişmemelidir.
a. Zayıf bir asit ve bu asitin tuzunun karışımından oluşan çözeltiler tampon çözeltidir.

b. Zayıf bir baz ve bu bazın tuzunun karışımından oluşan çözeltiler tampon çözeltidir.

• Kuvvetli bir baz ile zayıf bir asitin birleşmesiyle oluşan tuzlar bazik tuz özelliği gösterirler ve bu tuzların anyonu hidrolize uğrar.
• Zayıf asit ile zayıf bazın birleşmesiyle oluşan tuzlarda hem katyon, hem anyon hidrolize uğrar.
Kaynak:Sanaldersane
• ASİT – BAZ KAVRAMLARI
Asit: Sulu çözeltilere H+ iyonu verebilen maddelerdir.
Baz: Sulu çözeltilere OH– iyonu verebilen maddelerdir.
Diğer bir ifadeyle H+ iyonu verebilen maddelere asit, H+ iyonu alabilen maddelere baz denir.
Bu genel tanıma göre;
HF + H2O <==> H3O+ + F-
denkleminde HF, H+ iyonu verebildiğinden asit, H2O, H+ iyonu alabildiğinden bazdır.
Tepkime çift yönlü olduğundan H3O+ iyonu, H+ iyonu verebildiğinden asit, F– ise H+ alabildiğinden bazdır.
HF + H2O <==>H3O+ + F-
Asit-1...Baz-2......Asit-2...Baz-1
şeklinde yazılabilir. Bu ise herbir asit ve bazın birer eşlenik asit-baz çiftinden oluştuğunu gösterir.
Örnek olarak:
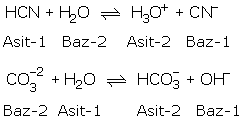
Aynı numarayla gösterilen asit baz çiftine konjuge asit-baz çifti denir.
SUYUN İYON DENKLEMİ
Su çok az dahi olsa elektrik akımını ilettiğine göre, su içerisinde iyonların bulunduğu aklımıza gelmelidir.
H2O(s) <==> H+(aq) + OH-(aq)
şeklinde iyonlaşır.
Olay bir denge olayı olduğundan denge sabitine suyun denge sabiti (Ksu) denir.
25 °C de deneysel olarak Ksu değeri 1.10–14 olarak hesaplanmıştır.
Ksu = [H+].[OH–]
eşitliği bütün sulu çözeltiler için geçerlidir.
Asit suya H+ iyonu vereceğine göre [H+] = [OH–] eşitliği bozularak [H+] > [OH–] olacaktır.
Baz suya OH– iyonu verecek ya da H+ iyonu alacaktır.
Baz çözeltisi için [H+] < [OH–] söz konusu olacaktır.
[H+] = [OH–] = 1.10–7 M ise ortam nötr
[H+] > [OH–] ise çözelti asidik
[H+] < [OH–] ise çözelti bazik
[H+] > 1.10–7 M ise çözelti asit
[H+] < 1.10–7 M ise çözelti baz
[OH–] > 1.10–7 M ise çözelti baz
Not: Bir çözelti asit çözeltisi ise işlemler H+ iyonlarıyla yapılmalıdır. Çözelti baz çözeltisi ise işlemler OH– iyonlarıyla yapılmalıdır.
pH ve pOH
pH = –log[H+]
pOH = –log[OH–]
pH + pOH = 14
eşitlikleri yardımıyla bir çözeltinin [H+] derişimi ya da [OH–] derişimi bilinirse pH’ı ya da pOH'sı, pH'ı ya da pOH'ı bilinen bir çözeltinin [H+] derişimi ya da [OH–] derişimi bulunur.
Saf su için;
[H+]= [OH–]= 1.10–7 olduğundan
pH = –log[1.10–7]
pH = 7
pOH = –log[1.10–7]
pOH = 7 bulunur.
Asit
1. [H+] > [OH–]
2. [H+] > 10–7 M
3. [OH–] < 10–7 M
4. pH < 7
5. pOH > 7
6. pH < pOH
Baz
1. [H+] < [OH–]
2. [H+] < 10–7 M
3. [OH–] > 10–7 M
4. pH > 7
5. pOH < 7
6. pH > pOH
Örnek - 1
Bir asit çözeltisinin [H+] derişimi 1.10–3 M ise bu çözeltinin pH ve pOH'ı nedir?
Çözüm
[H+] = 1.10–3 M ise
pH = –log[H+]
pH = –log[1.10–3]
pH = 3
pOH = 11 olarak bulunur.
ZAYIF ASİT ve BAZLAR (Ka ve Kb)
Kuvvetli asitler ve bazlar suda % 100 iyonlaştıklarından bunlarla ilgili soruları denge sabiti kullanmadan çözüyorduk. Ancak zayıf asit ve bazlarda %100 iyonlaşma olmadığından bir denge söz konusudur.
Zayıf HA asiti için;

Şeklinde denge denklemleri yazılabilir.

Zayıf asitler için uygulanan işlemlerden hareket ederek zayıf bazlar için gerekli eşitlikler elde edilebilir.
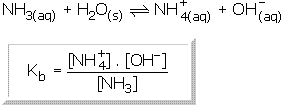
Örnek - 2
0,1 M lık HA asitinin pH =3 tür. Buna göre, asitin Ka sı kaçtır?
Çözüm
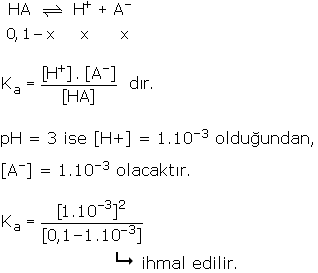
0,1 in yanında 1.10–3 çok küçük olduğundan ihmal edilir.
Ka = 1.10–5 olarak hesaplanır.
NÖTÜRLEŞME
Asit + Baz --> Tuz + H2O
reaksiyonuna nötrleşme reaksiyonu denir. Herhangi bir asitle herhangi bir bazın tepkimeye girerek tuz oluşturması işlemine nötrleşme olayı denir.
Genel nötürleşme denklemi
H+ + OH– --> H2O şeklindedir.
Asitten gelen H+ iyonlarıyla bazdan gelen OH– iyonlarının birleşmesi olayı nötürleşmedir. Asitten gelen H+ iyonlarının mol sayısı ile, bazdan gelen OH– iyonlarının mol sayısı birbirine eşit ise ortam nötr olur. Yani pH = 7 olur.
TAMPON ÇÖZELTİLER
Sinan Hoca diyor ki;
Herhangi bir çözeltinin pH değerini değişime karşı direndirmek amacı için hazırlanan çözeltilerdir. Yani tampon çözeltilerin pH'ları belirli değerlerde sabitlenmiştir değiştirilmesi normal çözeltilere göre zordur. Örneğin insan kanı doğal bir tampon çözeltidir çünkü kan pH'ı insan yaşamı için değişmemelidir.
a. Zayıf bir asit ve bu asitin tuzunun karışımından oluşan çözeltiler tampon çözeltidir.

b. Zayıf bir baz ve bu bazın tuzunun karışımından oluşan çözeltiler tampon çözeltidir.

• Kuvvetli bir baz ile zayıf bir asitin birleşmesiyle oluşan tuzlar bazik tuz özelliği gösterirler ve bu tuzların anyonu hidrolize uğrar.
• Zayıf asit ile zayıf bazın birleşmesiyle oluşan tuzlarda hem katyon, hem anyon hidrolize uğrar.
Kaynak:Sanaldersane
1 sayfadaki 1 sayfası
Bu forumun müsaadesi var:
Bu forumdaki mesajlara cevap veremezsiniz
