Konu-7: Entalpi
3 posters
1 sayfadaki 1 sayfası
 Konu-7: Entalpi
Konu-7: Entalpi
REAKSİYON ENTALPİSİ
• REAKSİYON ENTALPİSİ (ISISI)
Reaksiyonlar ısı yönüyle ikiye ayrılır.
1. Ekzotermik reaksiyonlar (ısı veren)
2. Endotermik reaksiyonlar (ısı alan)
Bir kimyasal reaksiyon söz konusu ise mutlaka enerji değişimi olur. Ya dışarıya ısı verilir ya da çevreden ısı alınır.
H2+ 1/2 O2 --> H2O + 68 k.kal (Ekzotermik reaksiyon)
N2 + O2 + 42 k.kal --> 2NO (Endotermik reaksiyon)
ENTALPİ (^H)
Herhangi bir madde bir kimyasal reaksiyonda dışarıya enerji vererek başka bir maddeye dönüşüyorsa, açığa çıkan enerji önceden başlangıçtaki maddede depo edilmiş halde bulunmalıdır.
Aynı şekilde oluşan maddeler de, başka bir maddeye dönüşürken gene enerji verebildiklerine göre bu maddelerde depo edilmiş enerji vardır denilebilir.
Herhangi bir maddenin kimyasal yapısına bağlı olarak depo edilmiş olan bu enerjiye ısı kapsamı denir. Sabit basınçta H ile gösterilir.
İç enerji değişimine entalpi adı verilir. Her maddenin kendi içinde bulundurduğu bir iç enerjisi vardır.
^H ile gösterilir.
Bir maddenin katı, sıvı, gaz hallerinde entalpi değerleri farklıdır.
Entalpi;
a. Madde miktarına
b. Maddenin fiziksel haline
c. Basınca bağlıdır.
^H : (+) işaretli ise ya da ^H > 0 ise olay endotermiktir.
^H : (-) işaretli ise ya da ^H < 0 ise olay ekzotermiktir.
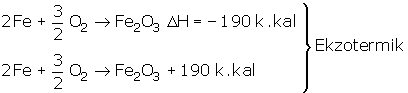
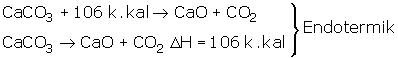
OLUŞUM ENTALPİSİ (ISISI)
Elementlerin ve tabiatta bulunan halleri ile tek cins atomdan oluşmuş moleküllerin
(Na, Fe, H2, O2…) entalpileri sıfır kabul edilmiştir.
Elementlerin bir araya gelerek 1 mol bileşik oluştururken kullanılan ısıya ya da açığa çıkan ısıya oluşum entalpisi denir.
C + O2 --> CO2 ^H = -94 k.kal
C ve O2'nin entalpisi sıfır olduğundan CO2'nin oluşum entalpisi -94 k.kal/mol'dür.
2Fe + 3/2 O2 --> Fe2O3 + 190 k.kal
denklemine göre Fe ve O2'nin entalpileri sıfır olduğundan Fe2O3'ün oluşum entalpisi
–190 k.kal/mol' dür denilir.
REAKSİYON ENTALPİSİ
^H=^Hürünler-^Hgirenler
Ürünlerin oluşum entalpileri toplamından, girenlerin oluşum entalpileri toplamı çıkarılarak reaksiyonun ^H'ı hesaplanır.
HESS KANUNU
(Reaksiyon Isılarının Toplanabilirliği)
Bir reaksiyon ister tek kademede oluşsun, isterse birden fazla tepkimenin toplamından oluşsun neticede ısı değişimi aynı olur.
Bir tepkimenin entalpisi, tepkimenin izlediği yola (kademe sayısı) bağlı değildir.
I. Reaksiyon ters çevrilince ^H işaret değiştirir.
II. Reaksiyon herhangi bir katsayı ile çarpılırsa ^H'da çarpılır.
III. Reaksiyonlar toplanırsa ^H'lar da toplanır.
şeklinde sıralanır.
Örnek
2A + 3B --> 4C + 3D ^H=+a k.kal
A + 3E -->2C + 3D ^H= - b k.kal
olarak verildiğine göre;
B+D --> 2E
tepkimesinin ^H değeri a ve b cinsinden nedir?
Çözüm
Verilen denklemler yardımıyla bilinmeyen denklemin ^H'ı hesaplanacaktır.
Bu işlem için I. denklem 1/3 ile çarpılmalıdır.
Çünkü sorulan denklemde B bir mol'dür.
I. denklemin ^H değeri a/3 olur.
II. denklem ters çevrilmeli ve 2/3 ile çarpılmalıdır.
ters çevrildiği için -b değeri b ye ve 2/3 b olur. tepkimeler toplandığından ^H'lar da toplanır.
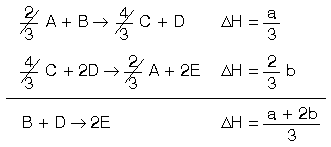
HAL DEĞİŞMELERİ
Bir maddeye verilen enerji maddenin sıcaklığını artırıyorsa maddeye verilen enerji
Q = m.c.^t formülüyle hesaplanır. Maddeye verilen enerji maddenin sıcaklığını değiştirmeden fiziksel halini değiştiriyorsa maddeye verilen enerji Q = m.l formülü ile hesaplanır.
Katı bir maddenin ısıtılması sırasında erime noktasına kadar maddenin sıcaklığı artar ve katının ısınması sırasında aldığı ısı;
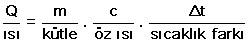
formülüyle bulunur.
Erime noktasına gelmiş olan katının erime süresince sıcaklığı değişmez, fakat maddeyi eritmek için ısı verilmektedir. Bu verilen ısı maddenin katı halden, sıvı hale geçmesini sağlamaktadır.
Q = m.le
le: Bir maddenin 1 gramının katı halden sıvı hale geçebilmesi için verilmesi gereken ısı miktarıdır.
Tamamen sıvı hale dönüşmüş olan maddeye ısı verilmeye devam edilirse sıvı ısınmaya başlar ve kaynama noktasına kadar sıcaklığı artar.
Q = m.c.^t ile sıvının aldığı ısı bulunur.
Sıvı kaynamaya başladığı andan, tamamen buharlaşıncaya kadar geçen zaman içerisinde sıcaklığı değişmez.
Verilen ısı Q = m.lb (lb: 1 gram maddenin sıvı halden, gaz hale geçmesi için verilen ısıdır.)
Tamamen gaz haline geçen maddeye ısı verilmeye devam edilirse gazın sıcaklığı artacaktır ve gazın aldığı ısı Q = m.c.^t formülü ile bulunur.
Bir maddeye verilen ısı, o maddenin ya sıcaklığında bir değişiklik yapar ya da halinde (durumunda) bir değişiklik yapar. Bir madde erime noktasına kadar ısıtıldıktan sonra erimesi tamamlanıncaya kadar verdiğimiz enerji sıcaklık değişimine sebep olamaz. Dolayısıyla verilen enerji maddenin hal değişimine uğramasına yol açmıştır.
(Buz için ısınma eğrisi)
Not: Farklı sıcaklıklarda iki madde karıştırıldığında sıcaklığı fazla olandan düşük olana ısı geçişi olacaktır.
Her zaman Q verilen=Q alınan
BAĞ ENERJİLERİ
İki atom arasındaki bağı koparabilmek için verilmesi gereken enerjiye bağ enerjisi denir.
Bağın koparılması endotermik bir olay olduğuna göre bağın oluşumu ekzotermiktir.
Bağ oluşurken koparmak için verdiğimiz enerji kadar ısı açığa çıkar.
Bağ enerjisi ne kadar fazla ise bileşik o kadar kararlıdır.
Bağ enerjileri kullanılarak reaksiyonun ^H'ı hesaplanabilir.
NOT : Herhangi bir kimyasal reaksiyon oluşması için reaksiyona giren maddelerin belirli bir enerjiye sahip olmaları gerekir. Bu enerji bağı koparmak için verilmesi gereken enerjidir.
Kaynak:Sanaldersane
• REAKSİYON ENTALPİSİ (ISISI)
Reaksiyonlar ısı yönüyle ikiye ayrılır.
1. Ekzotermik reaksiyonlar (ısı veren)
2. Endotermik reaksiyonlar (ısı alan)
Bir kimyasal reaksiyon söz konusu ise mutlaka enerji değişimi olur. Ya dışarıya ısı verilir ya da çevreden ısı alınır.
H2+ 1/2 O2 --> H2O + 68 k.kal (Ekzotermik reaksiyon)
N2 + O2 + 42 k.kal --> 2NO (Endotermik reaksiyon)
ENTALPİ (^H)
Herhangi bir madde bir kimyasal reaksiyonda dışarıya enerji vererek başka bir maddeye dönüşüyorsa, açığa çıkan enerji önceden başlangıçtaki maddede depo edilmiş halde bulunmalıdır.
Aynı şekilde oluşan maddeler de, başka bir maddeye dönüşürken gene enerji verebildiklerine göre bu maddelerde depo edilmiş enerji vardır denilebilir.
Herhangi bir maddenin kimyasal yapısına bağlı olarak depo edilmiş olan bu enerjiye ısı kapsamı denir. Sabit basınçta H ile gösterilir.
İç enerji değişimine entalpi adı verilir. Her maddenin kendi içinde bulundurduğu bir iç enerjisi vardır.
^H ile gösterilir.
Bir maddenin katı, sıvı, gaz hallerinde entalpi değerleri farklıdır.
Entalpi;
a. Madde miktarına
b. Maddenin fiziksel haline
c. Basınca bağlıdır.
^H : (+) işaretli ise ya da ^H > 0 ise olay endotermiktir.
^H : (-) işaretli ise ya da ^H < 0 ise olay ekzotermiktir.
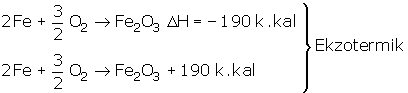
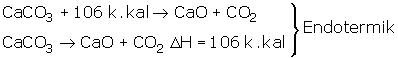
OLUŞUM ENTALPİSİ (ISISI)
Elementlerin ve tabiatta bulunan halleri ile tek cins atomdan oluşmuş moleküllerin
(Na, Fe, H2, O2…) entalpileri sıfır kabul edilmiştir.
Elementlerin bir araya gelerek 1 mol bileşik oluştururken kullanılan ısıya ya da açığa çıkan ısıya oluşum entalpisi denir.
C + O2 --> CO2 ^H = -94 k.kal
C ve O2'nin entalpisi sıfır olduğundan CO2'nin oluşum entalpisi -94 k.kal/mol'dür.
2Fe + 3/2 O2 --> Fe2O3 + 190 k.kal
denklemine göre Fe ve O2'nin entalpileri sıfır olduğundan Fe2O3'ün oluşum entalpisi
–190 k.kal/mol' dür denilir.
REAKSİYON ENTALPİSİ
^H=^Hürünler-^Hgirenler
Ürünlerin oluşum entalpileri toplamından, girenlerin oluşum entalpileri toplamı çıkarılarak reaksiyonun ^H'ı hesaplanır.
HESS KANUNU
(Reaksiyon Isılarının Toplanabilirliği)
Bir reaksiyon ister tek kademede oluşsun, isterse birden fazla tepkimenin toplamından oluşsun neticede ısı değişimi aynı olur.
Bir tepkimenin entalpisi, tepkimenin izlediği yola (kademe sayısı) bağlı değildir.
I. Reaksiyon ters çevrilince ^H işaret değiştirir.
II. Reaksiyon herhangi bir katsayı ile çarpılırsa ^H'da çarpılır.
III. Reaksiyonlar toplanırsa ^H'lar da toplanır.
şeklinde sıralanır.
Örnek
2A + 3B --> 4C + 3D ^H=+a k.kal
A + 3E -->2C + 3D ^H= - b k.kal
olarak verildiğine göre;
B+D --> 2E
tepkimesinin ^H değeri a ve b cinsinden nedir?
Çözüm
Verilen denklemler yardımıyla bilinmeyen denklemin ^H'ı hesaplanacaktır.
Bu işlem için I. denklem 1/3 ile çarpılmalıdır.
Çünkü sorulan denklemde B bir mol'dür.
I. denklemin ^H değeri a/3 olur.
II. denklem ters çevrilmeli ve 2/3 ile çarpılmalıdır.
ters çevrildiği için -b değeri b ye ve 2/3 b olur. tepkimeler toplandığından ^H'lar da toplanır.
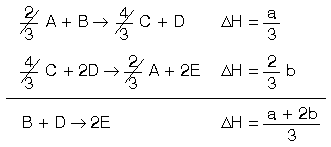
HAL DEĞİŞMELERİ
Bir maddeye verilen enerji maddenin sıcaklığını artırıyorsa maddeye verilen enerji
Q = m.c.^t formülüyle hesaplanır. Maddeye verilen enerji maddenin sıcaklığını değiştirmeden fiziksel halini değiştiriyorsa maddeye verilen enerji Q = m.l formülü ile hesaplanır.
Katı bir maddenin ısıtılması sırasında erime noktasına kadar maddenin sıcaklığı artar ve katının ısınması sırasında aldığı ısı;
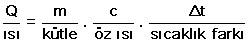
formülüyle bulunur.
Erime noktasına gelmiş olan katının erime süresince sıcaklığı değişmez, fakat maddeyi eritmek için ısı verilmektedir. Bu verilen ısı maddenin katı halden, sıvı hale geçmesini sağlamaktadır.
Q = m.le
le: Bir maddenin 1 gramının katı halden sıvı hale geçebilmesi için verilmesi gereken ısı miktarıdır.
Tamamen sıvı hale dönüşmüş olan maddeye ısı verilmeye devam edilirse sıvı ısınmaya başlar ve kaynama noktasına kadar sıcaklığı artar.
Q = m.c.^t ile sıvının aldığı ısı bulunur.
Sıvı kaynamaya başladığı andan, tamamen buharlaşıncaya kadar geçen zaman içerisinde sıcaklığı değişmez.
Verilen ısı Q = m.lb (lb: 1 gram maddenin sıvı halden, gaz hale geçmesi için verilen ısıdır.)
Tamamen gaz haline geçen maddeye ısı verilmeye devam edilirse gazın sıcaklığı artacaktır ve gazın aldığı ısı Q = m.c.^t formülü ile bulunur.
Bir maddeye verilen ısı, o maddenin ya sıcaklığında bir değişiklik yapar ya da halinde (durumunda) bir değişiklik yapar. Bir madde erime noktasına kadar ısıtıldıktan sonra erimesi tamamlanıncaya kadar verdiğimiz enerji sıcaklık değişimine sebep olamaz. Dolayısıyla verilen enerji maddenin hal değişimine uğramasına yol açmıştır.
(Buz için ısınma eğrisi)
Not: Farklı sıcaklıklarda iki madde karıştırıldığında sıcaklığı fazla olandan düşük olana ısı geçişi olacaktır.
Her zaman Q verilen=Q alınan
BAĞ ENERJİLERİ
İki atom arasındaki bağı koparabilmek için verilmesi gereken enerjiye bağ enerjisi denir.
Bağın koparılması endotermik bir olay olduğuna göre bağın oluşumu ekzotermiktir.
Bağ oluşurken koparmak için verdiğimiz enerji kadar ısı açığa çıkar.
Bağ enerjisi ne kadar fazla ise bileşik o kadar kararlıdır.
Bağ enerjileri kullanılarak reaksiyonun ^H'ı hesaplanabilir.
NOT : Herhangi bir kimyasal reaksiyon oluşması için reaksiyona giren maddelerin belirli bir enerjiye sahip olmaları gerekir. Bu enerji bağı koparmak için verilmesi gereken enerjidir.
Kaynak:Sanaldersane
 Geri: Konu-7: Entalpi
Geri: Konu-7: Entalpi
işte bu benim konum harika bişey 


PSiKoPaT =)- Aktif Kullanıcı

- Mesaj Sayısı : 91
Yaş : 31
Nerden : nevs.
Kayıt tarihi : 16/08/08
 Geri: Konu-7: Entalpi
Geri: Konu-7: Entalpi
şu kimyayı bi sevemedim ya:) yaw ne kadr karışık bi konudur. hep kopyayla geçmiştim:D keşke yapabilseydim ama
yaw ne kadr karışık bi konudur. hep kopyayla geçmiştim:D keşke yapabilseydim ama

merzukkk- Yeni Kullanıcı

- Mesaj Sayısı : 44
Yaş : 34
Nerden : ist_A_nbul
Kayıt tarihi : 03/08/08
 Geri: Konu-7: Entalpi
Geri: Konu-7: Entalpi
Mezuka sen bana gelecektin bak o zaman kimya ne kadar kolay. Neyse artık biraz geç ama her zaman kapımız açık sen yeterki iste.. 
 Geri: Konu-7: Entalpi
Geri: Konu-7: Entalpi
hehe  ...ben seviyorum çünkü sinan hocamın dedigini yaptım
...ben seviyorum çünkü sinan hocamın dedigini yaptım  anlamadım mıı==>basvuru sinan elaçmaz
anlamadım mıı==>basvuru sinan elaçmaz 

PSiKoPaT =)- Aktif Kullanıcı

- Mesaj Sayısı : 91
Yaş : 31
Nerden : nevs.
Kayıt tarihi : 16/08/08
1 sayfadaki 1 sayfası
Bu forumun müsaadesi var:
Bu forumdaki mesajlara cevap veremezsiniz