Konu: Asit ve Bazlar-II
1 sayfadaki 1 sayfası
 Konu: Asit ve Bazlar-II
Konu: Asit ve Bazlar-II
Asit - Bazlar
Bileşikler organik ve inorganik olmak üzere iki gruba ayrılır. İnorganik bileşikler de genel olarak kendi arasında asitler, bazlar, tuzlar ve oksitler şeklinde dörde ayrılır.
ASİTLER
Suda çözündüğünde H+ ya da H3O+ iyonu verebilen bileşiklerdir. Asitler genel olarak hidrojenin, ametal veya negatif yüklü iyonlarla (köklerin) yapmış olduğu bileşiklerdir. Bir asitin hidrojeninin dışındaki kısmına asit kökü denir.
Örneğin;
HCI, HNO3, H2SO4, H3PO4 ... (İnorganik asitler)
CH3COOH, HCOOH ... (Organik asitler)
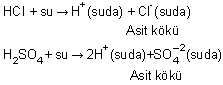
Asitlerin Genel Özellikleri:
1. Tatları ekşidir.
2. Mavi turnusolu kırmızıya çevirirler.
3. Bir asitin kuvvetliliği suda çözündüğünde iyonlarına ayrış-ma yüzdesi ile doğru orantılıdır.
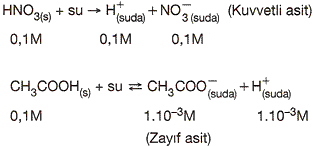
HNO3 suda çözündüğünde % 100 iyonlarına ayrıştığından kuvvetli, CH3COOH ise %100 iyonlaşmadığı için (suda iyonlaşma tepkimesi çift yönlü) zayıf asittir.
Flor dışındaki halojenlerin hidrojenle yaptığı bileşikler kuvvetli asitlerdendir. Bunların kendi aralarındaki kuvvetleri ise atom numarası arttıkça artar.
Örneğin: HI, HCI den daha kuvvetlidir.
• Bir elementin oksijenli asitlerinde kuvvetlilik, bir moleküldeki oksijen sayısı ile doğru orantılıdır.
Örneğin: H2SO4, H2SO3 ten, HClO4 de HCIO dan daha kuvvetlidir.
4. Sulu çözeltileri elektrik akımını iletirler. Aynı molar derişime sahip kuvvetli asit çözeltisi zayıf asit çözeltisinde daha iyi iletkendir.
Örneğin:
HCI(suda): İyi elektrolit HCN(suda): Zayıf elektrolittir.
Kuvvetlilik sırasına göre bazı asitler:
Kuvvetli asitler HCIO4, HI, HBr, HCI, HNO3, H2SO4...
Zayıf asitler HCOOH,CH3COOH, H2S,HCN...
5. Bir inorganik asitin etki (tesir) değeri, O molekülündeki H iyonu sayısına organik asitlerde ise molekülündeki -COOH (karboksil) grup sayısına eşittir.
6. Asitler; soy metal olan Au, Pt, Cu, Ag ve Hg nin dışındaki metallerle (Aktif metallerle) tepkimeye girerek H2 gazı açığa çıkarırlar.
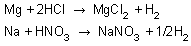
Soy metallerden Au ve Pt ye hiçbir asit tek başına etki etmez. Yarı soy metal olan Cu, Hg ve Ag ise oksijensiz asitlerle tepkime vermediği halde, oksijenli ve kuvvetli asit olan H2SO4 ve HNO3 gibi asitlerle tepkimeye girerek tuz, oksit gazı ve su oluştururlar.
7. Asitler, baz ve bazik oksitlerle nötürleşme tepkimesi verir-ler. Genellikle tuz ve su açığa çıkar.
Örneğin;
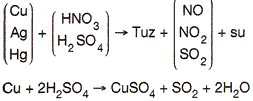
8. Asitler, bazik özellikteki karbonat tuzlarına etki ederek tuz, CO2 ve H2O açığa çıkarırlar.
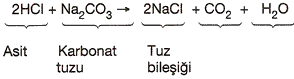
BAZLAR
Suda çözündüğünde OH- iyonu verebilen veya H+ iyonu alabilen maddelere denir. Bazlar genel olarak metallerin, OH- iyonu ile yapmış oldukları bileşiklerdir. NaOH, Ca(OH)2, Al(OH)3, NH3 ... baz bileşikleri
Bazların Genel Özellikleri:
1. Tatları acımsıdır.
2. Ele kayganlık verirler.
3. Kırmızı turnusolu maviye çevirirler.
4. Kuvvetlilikleri ölçüsünde sulu çözeltileri elektrik akımını iyi iletirler.
5. Bazların kuvvetliliği de suda çözündüğünde iyonlarına ayrışma yüzdesi ile doğru orantılıdır.
En kuvvetli bazlar, alkali metallerin (periyodik cetvelin lA grubu elementlerinin) Hidroksitli bileşikleridir. Alkali metallerin bazlarının kuvvetliliği, atom numarası arttıkça artar.
Örneğin; KOH, NaOH’dan daha kuvvetlidir.
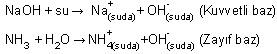
NaOH suda çözündüğünde %100 iyonlaştığı için kuvvetli baz, NH3 ise %100 iyonlaşmadığı için (çift yönlü okla belirtilmiş) zayıf bazdır.
6. Bazların etki değeri, bileşik formülündeki OH- iyonu sayı-sına eşittir.
7. Kuvvetli bazlar amfoter metallere etki ederek H2 gazı açığa çıkarır.
Amfoter metaller: Al, Zn, Cr, Sn, Pb ... dir.
Amfoterlik: Bir maddenin asitlere karşı baz, bazlara karşı asit özelliği göstermesine denir. Amfoter metallerin oksitleri ve hidroksitleri de amfoter özellik gösterir.
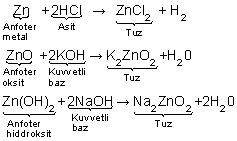
8. Bazlar, asit ve asit oksitlerle nötürleşme tepkimesi verirler.
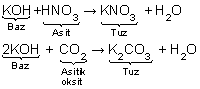
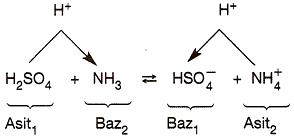
Konjuge Asit - Baz Çifti:
Suda çözündüğünde H+ verebilen maddeye asit, H+ iyonu bağlayabilen maddeye de baz denir.
Bu özelliği gösteren asit - baz çiftine konjuge asit baz çifti denir.
TUZLAR:
Metallerin veya amonyum kökünün asit kökleriyle yapmış oldukları bileşiklere denir. Metal: K, Na, Mg, Ca, Al, Fe ... Asit kökü: F-, Cl-, , , ...
Örneğin:
KF, NaCI, MgSO4, Ca(NO3)2 ... tuz bileşikleri
Tuzların Genel Özellikleri
1. Tuzların sudaki çözeltileri elektrik akımını iletir.
2. Yapısında hidrojen bulunduran tuzların sulu çözeltileri genellikle asit, hidroksit bulunduranların sulu çözeltileri ise genellikle baz özelliği gösterir.
Örneğin:
Ca(OH)F tuzunun sulu çözeltisi bazik özellik gösterir.
(NH4)2SO4 tuzunun sulu çözeltisi ise asidik özellik gösterir.
3. Bir tuzu oluşturan asit ile baz eş kuvvetlilikte ise nötr, farklı kuvvetlilikte ise kuvvetli olanın özelliğinde tuz oluşur.
Örneğin:
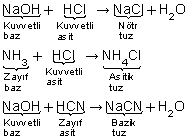
4. Genelde tuzların erime ve kaynama noktaları yüksektir.
5. Isıya dayanıksız bazı tuzlar ısının etkisiyle bozunurlar.
6. Asidik veya bazik tuzlar suda hidroliz olurlar.
Asidik veya bazik tuzların iyonlarından birinin (zayıf asit veya bazdan gelen) su ile H3O+ ya da OH- oluşturmasına hidroliz denir.
Kuvvetli asit + kuvvetli baz : X tuzu
Kuvvetli asit + zayıf baz : Y tuzu
Zayıf asit + kuvvetli baz : Z tuzu
Yukarıdaki tepkimelerde oluşan X, Y, Z tuzlarının saf sudaki çözeltilerine ilişkin;
I. Her üçü de elektrik akımını iletir.
Il. Z tuzunun çözeltisi mavi turnusolu kırmızıya çevirir.
III. X tuzu nötr özellik gösterir.
yargılarından hangileri doğrudur?
A) Yalnız I B) Yalnız II C) I ve III
D) II ve III E) I, II ve III
OKSITLER
Oksijenin -2 değerlik olarak her hangi bir elementle yaptığı bileşiklere oksit denir.
Oksit Çeşitleri:
A) Nötr Oksitler Asit ya da baz özelliği göstermeyen oksitlerdir. Genel olarak ametallerin yapısında tek oksijen bulunduran ve suda az çözünen oksitlerdir. NO, CO, N2O, H2O ... nötr oksitler.
B) Asit Oksitler: Suda çözündüğünde asit ve özelliği gösteren ve bazlarla nötürleşme tepkimesi veren ametallerin oksijence zengin oksitlerdir. Su ile birleşerek asitleri oluştururlar. SO2, SO3, CO2, N2O5… gibi
C) Bazik Oksitler: Suda çözündüğünde baz özelliği gösteren ve asitlerle nötürleşme tepkimesi veren metal oksitlerdir. Genel olarak alkali ve toprak alkali metaller ile diğer metallerin küçük değerlik alanlarının oksitleri baz özelliği gösterir. Su ile birle-şerek bazları oluştururlar. Na2O, K2O, MgO, CaO, MnO bazik oksit örnekleridir.
D) Amfoter Oksitler: Amfoter metallerin (Al, Zn, Cr, Pb, Sn) oksitleridir. Asitlerle ve kuvvetli bazlarla tepkime verirler. Suda çözünmezler. Al2O3, ZnO, PbO2 ... gibi.
E) Peroksitler: Oksijenin -1 değerlik aldığı oksitlerdir. Kararsız bileşiklerdir. Oksijen vererek parçalanırlar. 1A ve 2A grubu elementlerinin dışındaki elementlerin peroksitleri yoktur. Ağartıcıdırlar ve kuvvetli yükseltgendirler.
Örneğin: Na2O2, K2O2, H2O2 ,CaO2 peroksit örnekleridir.
F) Bileşik Oksit: Farklı değerlik alabilen metal oksitlerin birleşmesiyle oluşan oksitlerdir.
Oksitin yapısındaki metal farklı iki değerlik almış olmalıdır.
I. CO2
Il. MgO
IlI. NO
IV. H2O2
Yukarıda verilen oksitlere ilişkin aşağıdakilerden hangisi yanlıştır?
A) I ve Il nin tepkimesinden tuz oluşur.
B) Yalnız IV. bileşikte oksijen -1 değerlik almıştır.
C) I. ve III. asit oksittir.
D) Il. nin H2O ile birleşmesinden baz oluşur.
E) NO suda çok az çözünür.
Bileşikler organik ve inorganik olmak üzere iki gruba ayrılır. İnorganik bileşikler de genel olarak kendi arasında asitler, bazlar, tuzlar ve oksitler şeklinde dörde ayrılır.
ASİTLER
Suda çözündüğünde H+ ya da H3O+ iyonu verebilen bileşiklerdir. Asitler genel olarak hidrojenin, ametal veya negatif yüklü iyonlarla (köklerin) yapmış olduğu bileşiklerdir. Bir asitin hidrojeninin dışındaki kısmına asit kökü denir.
Örneğin;
HCI, HNO3, H2SO4, H3PO4 ... (İnorganik asitler)
CH3COOH, HCOOH ... (Organik asitler)
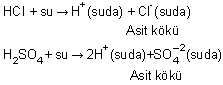
Asitlerin Genel Özellikleri:
1. Tatları ekşidir.
2. Mavi turnusolu kırmızıya çevirirler.
3. Bir asitin kuvvetliliği suda çözündüğünde iyonlarına ayrış-ma yüzdesi ile doğru orantılıdır.

HNO3 suda çözündüğünde % 100 iyonlarına ayrıştığından kuvvetli, CH3COOH ise %100 iyonlaşmadığı için (suda iyonlaşma tepkimesi çift yönlü) zayıf asittir.
Flor dışındaki halojenlerin hidrojenle yaptığı bileşikler kuvvetli asitlerdendir. Bunların kendi aralarındaki kuvvetleri ise atom numarası arttıkça artar.
Örneğin: HI, HCI den daha kuvvetlidir.
• Bir elementin oksijenli asitlerinde kuvvetlilik, bir moleküldeki oksijen sayısı ile doğru orantılıdır.
Örneğin: H2SO4, H2SO3 ten, HClO4 de HCIO dan daha kuvvetlidir.
4. Sulu çözeltileri elektrik akımını iletirler. Aynı molar derişime sahip kuvvetli asit çözeltisi zayıf asit çözeltisinde daha iyi iletkendir.
Örneğin:
HCI(suda): İyi elektrolit HCN(suda): Zayıf elektrolittir.
Kuvvetlilik sırasına göre bazı asitler:
Kuvvetli asitler HCIO4, HI, HBr, HCI, HNO3, H2SO4...
Zayıf asitler HCOOH,CH3COOH, H2S,HCN...
5. Bir inorganik asitin etki (tesir) değeri, O molekülündeki H iyonu sayısına organik asitlerde ise molekülündeki -COOH (karboksil) grup sayısına eşittir.
6. Asitler; soy metal olan Au, Pt, Cu, Ag ve Hg nin dışındaki metallerle (Aktif metallerle) tepkimeye girerek H2 gazı açığa çıkarırlar.
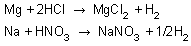
Soy metallerden Au ve Pt ye hiçbir asit tek başına etki etmez. Yarı soy metal olan Cu, Hg ve Ag ise oksijensiz asitlerle tepkime vermediği halde, oksijenli ve kuvvetli asit olan H2SO4 ve HNO3 gibi asitlerle tepkimeye girerek tuz, oksit gazı ve su oluştururlar.
7. Asitler, baz ve bazik oksitlerle nötürleşme tepkimesi verir-ler. Genellikle tuz ve su açığa çıkar.
Örneğin;
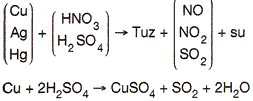
8. Asitler, bazik özellikteki karbonat tuzlarına etki ederek tuz, CO2 ve H2O açığa çıkarırlar.
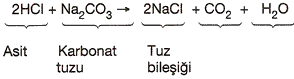
BAZLAR
Suda çözündüğünde OH- iyonu verebilen veya H+ iyonu alabilen maddelere denir. Bazlar genel olarak metallerin, OH- iyonu ile yapmış oldukları bileşiklerdir. NaOH, Ca(OH)2, Al(OH)3, NH3 ... baz bileşikleri
Bazların Genel Özellikleri:
1. Tatları acımsıdır.
2. Ele kayganlık verirler.
3. Kırmızı turnusolu maviye çevirirler.
4. Kuvvetlilikleri ölçüsünde sulu çözeltileri elektrik akımını iyi iletirler.
5. Bazların kuvvetliliği de suda çözündüğünde iyonlarına ayrışma yüzdesi ile doğru orantılıdır.
En kuvvetli bazlar, alkali metallerin (periyodik cetvelin lA grubu elementlerinin) Hidroksitli bileşikleridir. Alkali metallerin bazlarının kuvvetliliği, atom numarası arttıkça artar.
Örneğin; KOH, NaOH’dan daha kuvvetlidir.
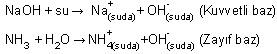
NaOH suda çözündüğünde %100 iyonlaştığı için kuvvetli baz, NH3 ise %100 iyonlaşmadığı için (çift yönlü okla belirtilmiş) zayıf bazdır.
6. Bazların etki değeri, bileşik formülündeki OH- iyonu sayı-sına eşittir.
7. Kuvvetli bazlar amfoter metallere etki ederek H2 gazı açığa çıkarır.
Amfoter metaller: Al, Zn, Cr, Sn, Pb ... dir.
Amfoterlik: Bir maddenin asitlere karşı baz, bazlara karşı asit özelliği göstermesine denir. Amfoter metallerin oksitleri ve hidroksitleri de amfoter özellik gösterir.
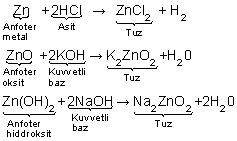
8. Bazlar, asit ve asit oksitlerle nötürleşme tepkimesi verirler.
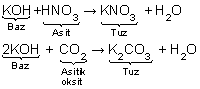
Konjuge Asit - Baz Çifti:
Suda çözündüğünde H+ verebilen maddeye asit, H+ iyonu bağlayabilen maddeye de baz denir.
Bu özelliği gösteren asit - baz çiftine konjuge asit baz çifti denir.

TUZLAR:
Metallerin veya amonyum kökünün asit kökleriyle yapmış oldukları bileşiklere denir. Metal: K, Na, Mg, Ca, Al, Fe ... Asit kökü: F-, Cl-, , , ...
Örneğin:
KF, NaCI, MgSO4, Ca(NO3)2 ... tuz bileşikleri
Tuzların Genel Özellikleri
1. Tuzların sudaki çözeltileri elektrik akımını iletir.
2. Yapısında hidrojen bulunduran tuzların sulu çözeltileri genellikle asit, hidroksit bulunduranların sulu çözeltileri ise genellikle baz özelliği gösterir.
Örneğin:
Ca(OH)F tuzunun sulu çözeltisi bazik özellik gösterir.
(NH4)2SO4 tuzunun sulu çözeltisi ise asidik özellik gösterir.
3. Bir tuzu oluşturan asit ile baz eş kuvvetlilikte ise nötr, farklı kuvvetlilikte ise kuvvetli olanın özelliğinde tuz oluşur.
Örneğin:
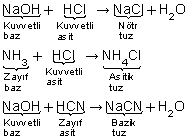
4. Genelde tuzların erime ve kaynama noktaları yüksektir.
5. Isıya dayanıksız bazı tuzlar ısının etkisiyle bozunurlar.
6. Asidik veya bazik tuzlar suda hidroliz olurlar.
Asidik veya bazik tuzların iyonlarından birinin (zayıf asit veya bazdan gelen) su ile H3O+ ya da OH- oluşturmasına hidroliz denir.
Kuvvetli asit + kuvvetli baz : X tuzu
Kuvvetli asit + zayıf baz : Y tuzu
Zayıf asit + kuvvetli baz : Z tuzu
Yukarıdaki tepkimelerde oluşan X, Y, Z tuzlarının saf sudaki çözeltilerine ilişkin;
I. Her üçü de elektrik akımını iletir.
Il. Z tuzunun çözeltisi mavi turnusolu kırmızıya çevirir.
III. X tuzu nötr özellik gösterir.
yargılarından hangileri doğrudur?
A) Yalnız I B) Yalnız II C) I ve III
D) II ve III E) I, II ve III
OKSITLER
Oksijenin -2 değerlik olarak her hangi bir elementle yaptığı bileşiklere oksit denir.
Oksit Çeşitleri:
A) Nötr Oksitler Asit ya da baz özelliği göstermeyen oksitlerdir. Genel olarak ametallerin yapısında tek oksijen bulunduran ve suda az çözünen oksitlerdir. NO, CO, N2O, H2O ... nötr oksitler.
B) Asit Oksitler: Suda çözündüğünde asit ve özelliği gösteren ve bazlarla nötürleşme tepkimesi veren ametallerin oksijence zengin oksitlerdir. Su ile birleşerek asitleri oluştururlar. SO2, SO3, CO2, N2O5… gibi
C) Bazik Oksitler: Suda çözündüğünde baz özelliği gösteren ve asitlerle nötürleşme tepkimesi veren metal oksitlerdir. Genel olarak alkali ve toprak alkali metaller ile diğer metallerin küçük değerlik alanlarının oksitleri baz özelliği gösterir. Su ile birle-şerek bazları oluştururlar. Na2O, K2O, MgO, CaO, MnO bazik oksit örnekleridir.
D) Amfoter Oksitler: Amfoter metallerin (Al, Zn, Cr, Pb, Sn) oksitleridir. Asitlerle ve kuvvetli bazlarla tepkime verirler. Suda çözünmezler. Al2O3, ZnO, PbO2 ... gibi.
E) Peroksitler: Oksijenin -1 değerlik aldığı oksitlerdir. Kararsız bileşiklerdir. Oksijen vererek parçalanırlar. 1A ve 2A grubu elementlerinin dışındaki elementlerin peroksitleri yoktur. Ağartıcıdırlar ve kuvvetli yükseltgendirler.
Örneğin: Na2O2, K2O2, H2O2 ,CaO2 peroksit örnekleridir.
F) Bileşik Oksit: Farklı değerlik alabilen metal oksitlerin birleşmesiyle oluşan oksitlerdir.
Oksitin yapısındaki metal farklı iki değerlik almış olmalıdır.
I. CO2
Il. MgO
IlI. NO
IV. H2O2
Yukarıda verilen oksitlere ilişkin aşağıdakilerden hangisi yanlıştır?
A) I ve Il nin tepkimesinden tuz oluşur.
B) Yalnız IV. bileşikte oksijen -1 değerlik almıştır.
C) I. ve III. asit oksittir.
D) Il. nin H2O ile birleşmesinden baz oluşur.
E) NO suda çok az çözünür.
1 sayfadaki 1 sayfası
Bu forumun müsaadesi var:
Bu forumdaki mesajlara cevap veremezsiniz
